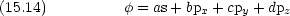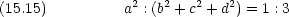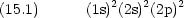
原子価結合法を多原子分子に適用したとき,原子軌道をそのままの形で考えていたのでは分子の構造を正しく説明出来ないことがある。
そのときに,混成軌道という考え方を用いればうまく説明できることがある。
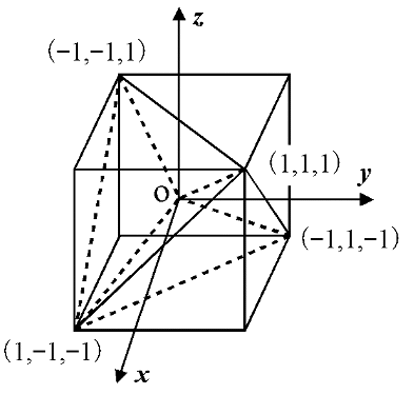
CH4 の 4 つの水素は化学的に等価であることが知られている。つまり,炭素の 4 つの結合は等価でなければならない。
しかし,炭素原子の電子構造は
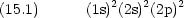
原点に C を置いたときの H の座標は (1,1,1), (1,-1,-1), (-1,1,-1), (-1,-1,1) なので
|
平面構造
z 軸を分子面に垂直な軸とする
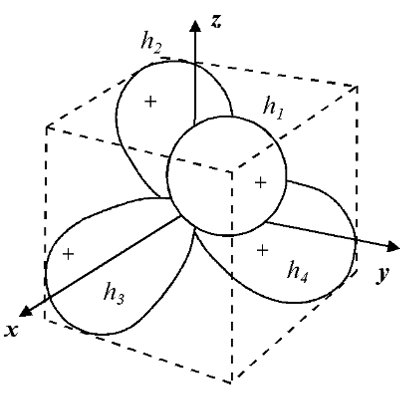
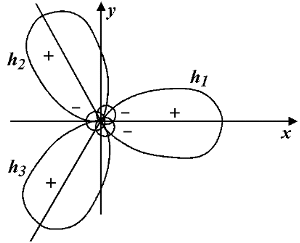
s, px, py のあいだで混成が起こる
(xy 面は pz 軌道の節面である)
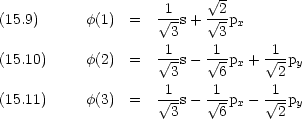
|
|
直線型構造
x 軸を分子軸とする
s, px のあいだで混成が起こる
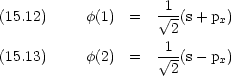
|
|
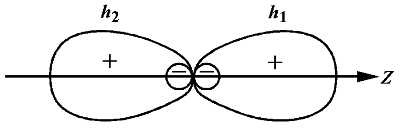
このような軌道を sp 混成軌道という
| 結合軸を含む共通な節面を |
|
2 重結合等を考える場合に重要
|
混成軌道
|
軌道数
|
立体構造 |
結合角
|
例
|
|
dsp2
|
4
|
正方形
|
90o
|
Ni(CN)42-, AuCl4-
|
|
sp3d
|
5
|
三方両錐
|
90o, 120o, 180o
|
PCl5, AsF5, SbCl5
|
|
d2sp3
|
6
|
正八面体
|
90o
|
Co(NH3)63+, PtCl62-
|
|
sp3d2
|
6
|
正八面体
|
90o
|
SF6
|