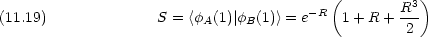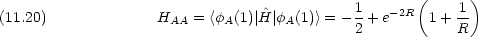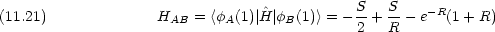|
Hamiltonian 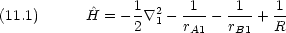
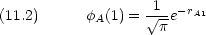
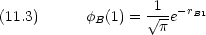
|

|
水素分子イオンは,陽子 2 個と電子 1 個からなる分子で,通常の条件下では安定に存在しないが放電管の中には存在している。
この系は,電子が元来 1 つしかないので,原子価結合法を用いて化学結合を説明することは不可能であり,全く別の考え方が必要になる。それは,分子全体に拡がった電子軌道(分子軌道)が存在しているという考え方である。
ここでは, LCAO 近似とよばれる近似を用いて,水素分子イオンの分子軌道を考察する
(副読本 pp. 129〜133)
|
Hamiltonian 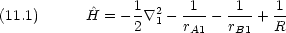
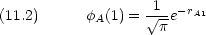
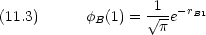
|

|
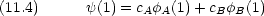
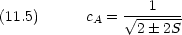

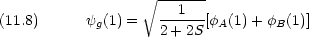
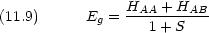
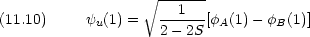
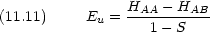
Coulomb 積分
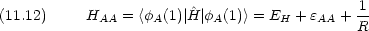
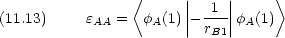
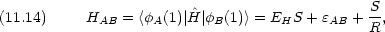
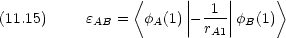
原子価結合法のときとの違いに注意する。
積分は回転楕円座標で計算できる。
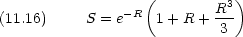
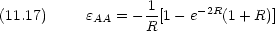
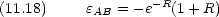
| 平衡核間距離 | 0.132 nm | (厳密解 0.106 nm) |
| 結合エネルギー | 1.76 eV | ( 〃 2.79 eV) |
結合性軌道と反結合性軌道
|
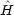 とする。
とする。