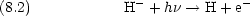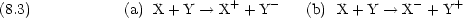M  M+ + e- M+ + e-
|
第一イオン化エネルギー I1 |
M+  M2+ + e- M2+ + e-
|
第二イオン化エネルギー I2 |
原子の電子構造について概説する。
基底状態における原子の構造は,構成原理, Pauli の原理, Hunt の原理にしたがって決まる。
また,イオン化エネルギー,電子親和力について述べる。
(副読本 pp. 97〜102)
原子番号 Z の原子の電子配置をかんがえる。 Z 個の電子が水素類似軌道を安定な順番に埋めていく。
順 序 1s, 2s, 2p, 3s, 3p, (4s, 3d), 4p, (5s, 4d), 5p, (6s, 4f, 5d), 6p, (7s, 5f, 6d)
カッコ内の軌道は左ほど安定なことが多い(原子の種類によっては逆転する)
例 Ge (Z = 32) (1s)2 (2s)2 (2p)6 (3s)2 (3p)6 (3d)10 (4s)2 (4p)2
電子は 1 つの軌道に 2 つしか入ることはできない
1 つの軌道を占める 2 つの電子のスピンは互いに逆向きである
基底状態にある原子は不対電子の数が最高になる配置をとる
| 原子番号 | 原子記号 | 外殻電子配置 | 原子番号 | 原子記号 | 外殻電子配置 |
| 1 | H | 1s | 19 | K | 4s |
| 2 | He | 1s2 | 20 | Ca | 4s2 |
| 3 | Li | 2s | 21 | Sc | 3d 4s2 |
| 4 | Be | 2s2 | 22 | Ti | 3d2 4s2 |
| 5 | B | 2s2 2p | 23 | V | 3d3 4s2 |
| 6 | C | 2s2 2p2 | 24 | Cr | 3d4 4s2 |
| 7 | N | 2s2 2p3 | 25 | Mn | 3d5 4s2 |
| 8 | O | 2s2 2p4 | 26 | Fe | 3d6 4s2 |
| 9 | F | 2s2 2p5 | 27 | Co | 3d7 4s2 |
| 10 | Ne | 2s2 2p6 | 28 | Ni | 3d8 4s2 |
| 11 | Na | 3s | 29 | Cu | 3d9 4s2 |
| 12 | Mg | 3s2 | 30 | Zn | 3d10 4s2 |
| 13 | Al | 3s2 3p | 31 | Ga | 3d10 4s2 4p |
| 14 | Si | 3s2 3p2 | 32 | Ge | 3d10 4s2 4p2 |
| 15 | P | 3s2 3p3 | 33 | As | 3d10 4s2 4p3 |
| 16 | S | 3s2 3p4 | 34 | Se | 3d10 4s2 4p4 |
| 17 | Cl | 3s2 3p5 | 35 | Br | 3d10 4s2 4p5 |
| 18 | Ar | 3s2 3p6 | 36 | Kr | 3d10 4s2 4p6 |
8.5 イオン化エネルギー I
次の過程に必要なエネルギー
M  M+ + e- M+ + e-
|
第一イオン化エネルギー I1 |
M+  M2+ + e- M2+ + e-
|
第二イオン化エネルギー I2 |
実験的には,原子スペクトルの系列の端の
波長,光電効果,電子衝突等で測定できる。
イオン化エネルギーの周期性
|
次の過程で放出されるエネルギー
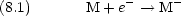
原子がとの程度電子を引きつけるかのめやす
Mulliken の定義 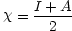
Pauling の定義
| I1/eV | A/eV | EN (M) | EN (P) | I1/eV | A/eV | EN (M) | EN (P) | ||||
| 1 | H | 13.60 | 0.754 | 7.18 | 2.1 | 19 | K | 4.34 | 0.501 | 2.42 | 0.8 |
| 2 | He | 24.59 | < 0 | 20 | Ca | 6.11 | < 0 | 1.0 | |||
| 3 | Li | 5.39 | 0.618 | 3.00 | 1.0 | 21 | Sc | 6.54 | 0.188 | 3.36 | 1.3 |
| 4 | Be | 9.32 | < 0 | 1.5 | 22 | Ti | 6.82 | 0.079 | 3.45 | 1.5 | |
| 5 | B | 8.30 | 0.277 | 4.29 | 2.0 | 23 | V | 6.74 | 0.525 | 3.63 | 1.6 |
| 6 | C | 11.26 | 1.263 | 6.26 | 2.5 | 24 | Cr | 6.77 | 0.666 | 3.72 | 1.6 |
| 7 | N | 14.53 | -0.07 | 7.23 | 3.0 | 25 | Mn | 7.44 | < 0 | 1.5 | |
| 8 | O | 13.62 | 1.461 | 7.54 | 3.5 | 26 | Fe | 7.87 | 0.163 | 4.02 | 1.8 |
| 9 | F | 17.42 | 3.399 | 10.41 | 4.0 | 27 | Co | 7.86 | 0.661 | 4.26 | 1.8 |
| 10 | Ne | 21.56 | < 0 | 28 | Ni | 7.64 | 1.056 | 4.35 | 1.8 | ||
| 11 | Na | 5.14 | 0.548 | 4.69 | 0.9 | 29 | Cu | 7.73 | 1.228 | 4.48 | 1.9 |
| 12 | Mg | 7.65 | < 0 | 1.2 | 30 | Zn | 9.39 | < 0 | 1.6 | ||
| 13 | Al | 5.99 | 0.441 | 3.22 | 1.5 | 31 | Ga | 6.00 | 0.300 | 3.15 | 1.6 |
| 14 | Si | 8.15 | 1.385 | 4.77 | 1.8 | 32 | Ge | 7.90 | 1.200 | 4.55 | 1.8 |
| 15 | P | 10.49 | 0.747 | 5.62 | 2.1 | 33 | As | 9.81 | 0.810 | 5.31 | 2.0 |
| 16 | S | 10.36 | 2.077 | 6.22 | 2.5 | 34 | Se | 9.75 | 2.020 | 5.89 | 2.4 |
| 17 | Cl | 12.97 | 3.617 | 8.29 | 3.0 | 35 | Br | 11.81 | 3.365 | 7.59 | 2.8 |
| 18 | Ar | 15.76 | < 0 | 36 | Kr | 14.00 | < 0 |